Vast, vloeibaar en gas
Vast, vloeibaar en gas
De bouwstenen van stoffen zijn moleculen.
Stoffen kun je onderverdelen in:
Vaste stoffen
In vaste stoffen zitten de moleculen dicht op elkaar geplakt.
De moleculen kunnen uitsluitend op hun plaats trillen.
Vloeibare stoffen
In vloeistoffen zitten de moleculen iets minder dicht op elkaar en kunnen ze langs elkaar heen bewegen.
Gassen
In gassen bewegen de moleculen op grote afstand van elkaar.

Faseovergangen
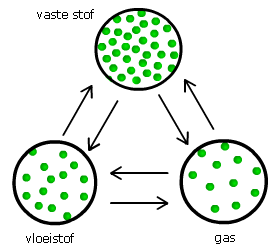
De meeste stoffen kunnen zowel voorkomen als vaste stof, als vloeistof en gasvormig.
Je spreekt van drie fasen waarin de stof voor kan komen.
In welke fase een stof voorkomt, is afhankelijk van de snelheid waarmee de moleculen
bewegen. Als de temperatuur van een stof verandert, verandert de snelheid waarmee
de moleculen bewegen.
Er zijn zes fase-overgangen mogelijk:
- van vast naar vloeibaar
- van vloeibaar naar vast
- van vloeibaar naar gas
- van gas naar vloeibaar
- van vast naar gas
- van gas naar vast.
Smelten en stollen
Als een vaste stof overgaat in een vloeistof noem je dat smelten.
Je spreekt van stollen als een vloeistof overgaat in een vaste stof.
Het smeltpunt of stolpunt is die temperatuur waarbij de moleculen zo snel
bewegen, dat de vaste stof overgaat in een vloeistof of omgekeerd.
Het smeltpunt of stolpunt verschilt per stof.
Daarom zijn het smeltpunt en stolpunt stofeigenschappen van de stof.
Het smeltpunt van water ligt bij 0 °C.
Het smeltpunt van alcohol ligt bij -114°C
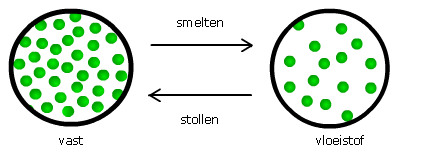
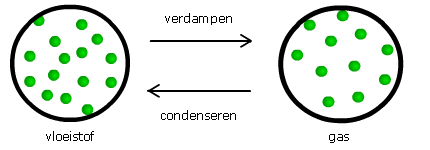
Verdampen en condenseren
Als een vloeistof over gaat in een gas noem je dat verdampen.
Je spreekt van condenseren als een gas overgaat in een vloeistof.
Het kookpunt is de temperatuur waarbij de moleculen zo snel bewegen dat ze
aan de vloeistof ontsnappen en gas worden.
Ook het kookpunt verschilt per stof.
Het kookpunt van water ligt bij 100 °C.
Het kookpunt van alcohol ligt bij 78°C
Rijpen en vervluchtigen
Rijpen is de overgang van een stof van de gas fase naar de vaste fase.
Normaal gaat de overgang gas naar vast in twee stappen.
Eerst condenseert het gas zodat het een vloeistof wordt die hierna kan stollen,
maar de vloeistoffase komt dus niet om de hoek kijken bij rijpen.
Het tegenovergestelde van rijpen wordt vervluchting of sublimeren genoemd.
Een voorbeeld van rijping is het ontstaan van ijsbloemen.
IJsbloemen ontstaan als waterdamp tegen een ruit aankomt waarvan
de temperatuur 0°C is.

Maak jouw eigen website met JouwWeb